点击上方“中国实用儿科杂志”关注我们
专题│儿童神经母细胞瘤
王景富
中国实用儿科杂志2018年33期(10):763-768
概括
神经母细胞瘤(NB)是儿童期最常见的颅外实体肿瘤。异质性是NB的主要特点:临床表现多样,涉及多个学科;分子特征和组织学类型个体差异大,预后要么自然消退,要么快速进展。治疗选择需要根据风险分层,其中高危组治疗最困难。治疗过程分为诱导治疗、巩固治疗和维持治疗三个阶段。随着单细胞研究和精准测序的引入,NB未来将进入免疫靶向治疗时代。
关键词
神经母细胞瘤;儿童;诊断;治疗
通讯作者: 天津医科大学附属肿瘤医院儿童肿瘤科,天津 300060
电子邮件:
神经母细胞瘤(NB)起源于交感神经节或双侧肾上腺,是儿童最常见的颅外实体肿瘤,占14岁以下儿童恶性肿瘤的7.2%。异质性是NB的主要特点:临床表现多样,涉及多个学科;分子特征和组织学类型个体差异大,变异多样;预后结局为自然消退或快速进展。由于存在异质性,临床分组和治疗需要分层。
1 临床特征
NB的临床表现取决于原发部位、转移器官和肿瘤负荷。临床症状和体征包括:肿块、贫血、发热、高血压、全身骨痛、熊猫眼、皮肤蓝莓样结节、头骨“乒乓”状隆起、横向截瘫、眼阵挛-共济失调综合征、霍纳综合征、难治性腹泻。以下5项是少见但相对有特征性的NB体征。(1)横向截瘫:位于颈部、胸部或腹部的NB迅速生长,经椎间孔侵入椎管,压迫脊髓,引起相应的神经系统症状。肿瘤多呈哑铃状。(2)眼阵挛-共济失调综合征:表现为舞眼、舞手、舞脚,常伴有认知、运动、行为、语言发育迟缓[1]。 目前认为其发病机制为肿瘤细胞与中枢神经元具有共同抗原,进而产生抗体介导的交叉免疫损害,其基础是此类患者瘤巢内存在弥漫淋巴细胞浸润。(3)Horner综合征:当NB侵犯颈交感神经节时,可发生Horner综合征,表现为单侧面部无汗、上睑下垂、瞳孔缩小、眼球内陷、虹膜异色。(4)难治性腹泻:约4%的患儿发生难治性腹泻,表现为低钾血症和脱水[2],原因是成熟的NB或成熟的神经节神经瘤分泌过多的血管活性肠肽。切除原发病灶可以缓解症状。(5)高血压:部分患儿有高血压。 主要原因是肿瘤压迫肾动脉,其次是肾脏缺血、肾素-血管紧张素系统激活;其次是肿瘤细胞分泌血管活性物质儿茶酚胺(多巴胺、肾上腺素、去甲肾上腺素)。若药物治疗无效,又无法切除原发病灶,可考虑手术游离肾动脉,解除肿瘤压迫,恢复肾脏血液供应,从而缓解肾性高血压。由于临床表现涉及多个器官和系统,患儿可能求医学科各异,因此了解NB的临床线索有利于早期诊断。
2 遗传分子变异与组织学分类
NB多为散发病例,偶有家族性病例。遗传学相关的种系突变包括ALK和PHOX2B,以及1p36或11q14-23缺失[3-5],更多的是获得性系统性突变。总体来说,NB的分子特点是:基因突变负荷低、可重复性好;突变分子多为转录因子,不利于小分子靶向药物抑制;常表现为染色体数目异常或大片段[6]。目前发现与NB预后及治疗分层相关的基因和分子包括(1)Trk家族:Trk家族是一组神经营养因子受体,包括TrkA、TrkB和TrkC,分别由NTRK1、NTRK2和NTRK3编码,其配体分别为NGF、BDNF和NT-3。 TrkA高表达与年轻化、低分期、生物学行为良好相关[7];而TrkB则恰恰相反,高表达与转移、不良生物学因素相关[8],尤其是MYCN扩增。正因如此,TrkB是一个良好的治疗靶点,相关小分子临床试验正在进行中。TrkC常与TrkA一起表达,其具体意义尚不明确,可能与TrkA协同发挥生物学效应[9]。(2)DNA倍体[10]:超二倍体,如三倍体,与预后良好相关,而二倍体或四倍体则与预后不良相关。(3)MYCN扩增[11]:MYCN位于2p24,20%的NB发生MYCN扩增,与肿瘤进展、治疗耐药密切相关。MYCN扩增的标准存在争议,一般认为大于4倍即可定义为“扩增”。 MYCN编码的蛋白是控制人类基因组中近15%基因的转录因子,因此其表达异常影响巨大,目前尚未获得有效的针对性小分子。但值得注意的是,虽然在某些不良病理类型病例中没有MYCN扩增,但MYCN高表达或MYC信号通路激活,与预后不良相关。(4)大片段染色体丢失或增加:最常见的是17q增加、1p36丢失、11q丢失。目前研究认为上述片段参与NB发生的候选基因有17q25(BIRC5/Survivin)、11q23(CADM1)、1p36(CHD5、miR34、KIF1BB)。 其中,11q缺失几乎发生在MYCN扩增阴性的病例中,可独立作为MYCN扩增阴性病例的预后预测因素[12],因此与MYCN一起被引入新的风险分层中。
1999年国际NB病理委员会正式发布了NB病理分类,大致分为形态学分类和预后分类两大类[13]。形态学分类依据是神经母细胞分化程度和施万细胞基质发育状态,具体如下。(1)NB(贫施万细胞基质):未分化、弱分化、中度分化。(2)神经节胶质神经瘤(富施万细胞基质)。(3)神经节胶质神经瘤(富施万细胞基质为主):中度成熟、成熟。(4)神经节胶质NB(混合型、富施万细胞基质或富施万细胞基质为主及贫)。预后分类依据是在形态学的基础上引入年龄和有丝分裂-核碎裂指数(MKI),MKI分为3级:低(<100/5000); 预后分为中等[(100~200)/5000]、高(>200/5000)两组。具体预后分类如下。(1)预后良好型:<1.5岁,低分化或分化性NB,MKI低或中等;1.5~5.0岁,分化性NB,MKI低;节细胞神经母细胞瘤(丰富施万细胞基质);节细胞神经瘤(施万细胞基质为主)。(2)预后不良型:<1.5岁,未分化或高MKI NB;1.5~5.0岁,未分化或低分化NB,或中等(或高)MKI NB;≥5岁,NB的各类亚型;节细胞神经瘤(混合型,丰富或占主导地位且施万细胞基质较少)。
3 肿瘤标志物及影像学评估方法
肿瘤标志物在肿瘤诊断、预后及病情监测中具有明显的临床意义,它们在肿瘤细胞转化和负荷增加的过程中发生改变。与NB相关的肿瘤标志物包括(1)儿茶酚胺代谢物[14]:儿茶酚胺代谢物是所有NB标志物中敏感性和特异性最高的,主要有香草扁桃酸(VMA)、高香草酸(HVA)和多巴胺,前两者临床意义较大。在采集24小时尿液时,尿液VMA或HVA的准确度较高,但对于较小的儿童,尿液采集较为困难。对于此类患儿,可采集某一点或几点尿液作为检测标本,同时测尿肌酐,然后计算[尿VMA(或HVA)]/尿肌酐比值(μg/mg),作为评价指标。 (2)神经元特异性烯醇化酶(NSE):NSE由神经母细胞合成,是免疫组化染色的重要指标。其在血清中可能升高,但由于在其他肿瘤如尤文氏家族肿瘤、小细胞肺癌、嗜铬细胞瘤等中也有高表达,因此其特异性相对较差。临床主要用于判断肿瘤负荷、复发监测。(3)铁蛋白及乳酸脱氢酶:均为NB的独立预后因素,升高代表肿瘤细胞转化增殖快,肿瘤负荷高,特异性较差,不能作为鉴别诊断的指标。
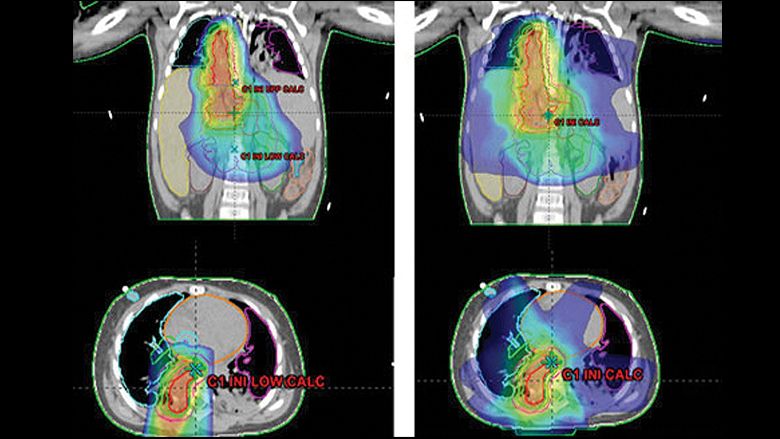
NB影像学检查应根据检查目的、费用、可获得性等选择。(1)超声:超声是筛查腹部及盆腔肿块最常用的检查方法,不仅能发现椎旁或肾上腺区域的原发病灶,还能确定周围有无淋巴结及肝脏转移,血管内有无癌栓,受压血管的血流情况,有无腹主动脉、下腔静脉或肾门血管等。原发病灶内有无钙化是重要特征。(2)CT:CT检查速度相对较快,能很好地显示钙化,对肺实质及皮质骨有无转移有较高的检出率,但在区分骨髓转移和皮质骨转移方面作用有限。CT不适用于监测骨病变对治疗的反应,因为骨骼异常可持续数月至数年。 (3)磁共振成像(MRI):与CT相比,MRI无电离辐射,能很好地评估椎间孔及硬膜外侵犯,可区分皮质骨和骨髓病变,并能准确判断肌肉和软组织受累范围。但其对钙化检测能力较低。(4)骨扫描:示踪剂为Tc99m-MDP,用于评估全身骨骼中是否存在转移。一些原发病灶中可出现Tc99m-MDP蓄积,提示有钙化存在。(5)间碘苄胍(MIBG)扫描:以MIBG为示踪剂,参与神经母细胞I型儿茶酚胺摄取和颗粒储存途径,即胺前体摄取和脱羧(APUD)。
MIBG转运入神经母细胞后,绝大部分滞留在胞浆内。目前有两种核素标记的MIBG:123I-MIBG和131I-MIBG。前者放射线危险性低,不需要严格的甲状腺防护,且能产生高质量的显像。目前已引入半定量评分方法用于结果解释,推荐3种方法。①居里评分[15]:a受累范围评分:各分区均无受累为0分,1个受累为1分,2个或以上受累为2分,50%以上受累为3分,最高评分总和为30分。b核素摄取强度评分:0分表示无摄取,1分表示可疑摄取,2分表示明确摄取且肝脏摄取不足,3分表示肝脏摄取超过。 最高总分30分。②Frappaz评分[16]:a受累范围评分:各分区无受累为0分,点状受累为1分,弥漫性受累为2分,最高总分14分。b核素摄取强度评分:无摄取为0分,可疑摄取为1分,明显但中度摄取为2分,非常强的摄取为3分,最高总分21分。③SIOPEN评分:仅包括受累范围的评分。 每个分区中,无受累为0分,1处受累为1分,2处散在受累为2分,3处散在受累为3分,3处以上散在受累或1处弥漫性受累且范围小于受累骨的50%为4分,弥漫性受累范围为50%~95%为5分,整个骨均受累(>95%)为6分。最高总分为72分。(6)正电子发射断层扫描(PET)/CT:其示踪剂为FDG(F-18氟脱氧葡萄糖),反映代谢活动强度,有利于发现远处转移。
4 小病灶或残留病灶的检测方法
微病灶或残留病灶的检测对确定NB的治疗方案非常重要。检测方法主要基于两种技术:免疫组化染色和定量聚合酶链式反应(PCR)。免疫组化可选择的抗原组为:GD2、NSE、NCAM和突触素,PCR可选择的抗原组为:酪氨酸羟化酶(TH)、GD2合酶和PgP9.5。国际NB
国际神经母细胞瘤风险组(INRG)合作组推荐以下两种方法用于微病变的检测[17]。 (1)基于GD2抗原的免疫细胞学检测:GD2在NB中稳定均一地表达,在血细胞中表达水平较低,是检测微病变的理想抗原。 检测标本为骨髓、外周血或干细胞,其过程为:用淋巴细胞分离液经离心得到单核细胞层,该层含有神经母细胞,用离心机得到细胞涂片,再用两步法进行GD2染色,最后判定并计数阳性细胞。 需要注意以下几个方面:每个患者需获得6张以上的涂片,每张涂片细胞数为5×105,观察到的细胞数超过3×106才达到微病变数量级; GD2为脂溶性物质,整个操作过程中应避免使用脂溶性试剂;二抗标记碱性磷酸酶,不能使用过氧化物酶,因为后者在骨髓中表达更丰富,易出现假阳性。(2)基于TH mRNA(酪氨酸羟化酶mRNA)的实时定量PCR:神经母细胞分泌儿茶酚胺,TH是儿茶酚胺合成的关键酶,因此采用TH mRNA定量分析来评估微病变。检测样本仍为骨髓、外周血或干细胞。
5 确定诊断标准
NB的确诊标准为下列之一[18]。(1)在肿瘤组织光学显微镜下获得阳性病理诊断(以下检查可以或可以不需:免疫组织化学染色、电子显微镜、血清或尿液儿茶酚胺或其代谢物升高)。(2)在骨髓穿刺涂片和活检中发现特征性的神经母细胞(排列成巢状或玫瑰花结的小圆形细胞;抗GD2抗体染色阳性),同时伴有血清或尿液儿茶酚胺或其代谢物升高。如果病理诊断不明确,基因和核型异常调查可以帮助诊断。 1p36缺失和/或MYCN扩增支持NB的诊断,而其他特征性染色体易位可排除诊断,如尤文氏肉瘤(t11;22)、非霍奇金淋巴瘤(t2;5)或(t8;14)、横纹肌肉瘤t(2;13)。儿茶酚胺代谢物包括多巴胺、VMA、HVA,增高必须大于同年龄段均值的3.0 SD。临床上部分病例被诊断为呼吸窘迫或纵隔受压致横向截瘫,需紧急放化疗。此时根据影像学特征、高水平儿茶酚胺及其代谢物、高MIBG亲和力即可进行临床诊断,患儿症状缓解后即可立即进行组织学诊断。 上述标准于1993年发布,由于分子特征对于治疗选择非常重要,特别是对于1.5岁以下的幼童,目前的临床试验仍然需要进行组织活检才能获得足够的标本进行分子分析,因此诊断标准中的第二项已逐渐失去临床应用价值。
6 图像定义的风险因素 (IDRF)、临床分期和风险分层
2009年INRG根据影像学表现提出了IDRFs[19],旨在指导手术时机选择,减少手术相关并发症。对于初诊NB,首先采用CT和/或MRI、123I-MIBG、Tc99m-MDP骨扫描显像技术评估原发灶和转移灶,若存在一种或多种上述IDRF,应推迟手术,并在手术治疗前先进行化疗,以减少手术并发症风险。IDRF根据不同部位定义如下:(1)单侧病变延伸至颈部-胸腔、胸腔-腹部、腹腔-盆腔两个区域。(2)颈部:肿瘤包围颈动脉和/或椎动脉和/或颈内静脉;肿瘤延伸至颅底;肿瘤压迫气管。 (3)颈胸结合部:肿瘤包围臂丛神经根;肿瘤包围锁骨下血管和(或)椎动脉和(或)颈动脉;肿瘤压迫气管。(4)胸部:肿瘤包围胸主动脉和(或)其主要分支;肿瘤压迫气管和(或)主支气管;低位后纵隔肿瘤侵犯T9与T12间肋椎结合部(因该处易损伤Adamkiewicz动脉)。(5)胸腹结合部:肿瘤包围主动脉和(或)下腔静脉。(6)腹部或盆腔:肿瘤侵犯肝门和(或)肝十二指肠韧带;肿瘤在肠系膜根部包围肠系膜上动脉分支; 肿瘤包围腹腔干和/或肠系膜上动脉起始处;肿瘤侵犯一侧或双侧肾蒂;肿瘤包围腹主动脉和/或下腔静脉;肿瘤包围髂血管;盆腔肿瘤越过坐骨切迹。(7)椎管内蔓延:在轴平面上肿瘤侵犯超过1/3的椎管,和/或脊髓周围软脑膜间隙消失,和/或脊髓信号异常。(8)邻近器官或组织受累:心包、膈肌、肾脏、肝脏、胰腺-十二指肠、肠系膜。以下情况应记录但不考虑IDRF:多发性原发病灶、伴或不伴恶性细胞的胸腔积液、伴或不伴恶性细胞的腹腔积液。
1971年Evans等[20]首先制定了NB的分期系统,随后日本、美国儿童肿瘤组(POG)也制定了各种分期标准,由于标准不统一,影响了疗效对比和临床试验的配合。随后制定了国际神经母细胞瘤分期系统(INSS)[18],于1988年首次提出,1993年修订发布,是临床上最广泛接受的分期系统。它是一种术后分期系统,手术医生的水平影响分期水平。2009年,INRG根据IDRFs和有无远处转移[19]发表了INRG分期系统,分为L1、L2、M和Ms。INRG分期系统是一种术前分期系统,不受手术医生水平的影响。 具体包括:L1:局限于一个区域,肿瘤在影像学上没有IDRF。不符合IDRF的孤立性椎管内肿瘤归入L1类。L2:局限于区域性病变,有一种或多种影像学表现的IDRF。病变位于同一侧连续两个区域(如左胸部和左腹部)归入L2,但如果病变明显位于对侧两个区域(如左腹部和右胸部),则认为是转移瘤。M:存在远处转移瘤(MS除外)。区域淋巴结转移不认为是远处转移,应归类为局限性病变。例如上腹部肿块伴下纵隔淋巴结转移或盆腔肿块伴腹股沟淋巴结肿大;原发病变同一区域有胸腔积液或腹腔积液,即使有肿瘤细胞,也不认为是远处转移。 MS:<18个月的婴儿,远处转移病灶局限于皮肤、肝脏和/或骨髓。骨髓中的肿瘤细胞<10%,骨骼和骨髓的123I-MIBG扫描必须为阴性,并且原发病灶已成为L1或L2,无论肿瘤是否越过中线。必须记录以下三种情况:多个原发病灶、胸腔积液和腹腔积液。如果有多个原发病灶,则根据受累最广泛的病灶进行分期。
目前国际上主要有两种风险分级系统:COG分级系统和2009年发布的INRG分级系统[21]。前者引入5个危险因素将NB分为低危、中危、高危三组,5个危险因素分别为:INSS、年龄、MYCN、国际NB病理分类、DNA倍体。后者引入7个危险因素将NB分为极低危、低危、中危、高危四组,7个危险因素分别为:INRG分期系统、年龄、MYCN、国际NB病理分类、肿瘤细胞分化、DNA倍体、11q异常。特别地,11q缺失的引入弥补了MYCN阴性病例的分层。
随着前瞻性临床试验结果的陆续出炉,一旦INRG分期及风险分级系统的有效性得到验证,未来可能将取代INSS分期和COG风险分级系统。
7 治疗策略
异质性是NB的重要特点,需区别对待,导致其具有儿童实体肿瘤中最复杂的治疗分层体系。低危、中危组治愈率很高,并不是NB治疗的重点,但高危组尽管采用多模式、大剂量化疗,预后依然较差,是NB治疗的核心。高危组NB治疗分为诱导期、巩固期、维持期三个阶段。(1)诱导期:采用化疗、手术或联合放疗,尽可能减少肿瘤细胞、将肿瘤负荷降至微小残留病灶水平。手术一般在4个疗程后进行,彻底切除原发病灶及同区内转移淋巴结,选择性切除远处转移灶。化疗一般为5~8个疗程。 常用方案和药物有拓扑替康(Topo)或伊立替康(Irino)+环磷酰胺(CTX)、顺铂(DDP)+依托泊苷(VP-16)及CTX+阿霉素(ADM)+长春新碱(VCR),交替循环进行。可在此阶段开始放疗,或推迟至巩固期。放疗的主要部位是原发瘤床及同室转移病灶,远处转移部位的放疗应有选择性,放疗剂量需根据年龄、肿瘤部位、残留量调整,范围为15~30Gy。(2)巩固期:采用干细胞支持的大剂量化疗,消灭诱导期残留的耐药细胞。 从最初的单例移植到现在的2例序贯移植,化疗方案也经历了多次修改和演变[22-24]:卡铂+依托泊苷+美法仑是单例移植的经典方案,后来发展出双例移植。除上述经典方案外,还出现了噻替派+CTX方案。后来发现美法仑+白消安优于卡铂+依托泊苷+美法仑方案,开始被更多的协作组接受并引入巩固治疗。
伊诺具有放射增敏作用,因此伊诺+VCR+131I-MIBG是目前临床治疗中很有前途的替代方案[25]。自体或异体干细胞移植的优缺点一直存在争议,虽然目前没有明确证据支持异体干细胞移植的优势,但考虑到免疫排斥的副作用,自体移植仍然被推荐。但由于存在移植物抗肿瘤效应,异体移植的探索并未完全放弃。自体干细胞采集存在肿瘤细胞污染的可能性,一些临床试验尝试纯化CD34+干细胞,但最终结果显示,无论是无事件生存期(EFS)还是总生存期(OS),均无差异[26]。原因是:初始诱导化疗后肿瘤细胞污染的可能性较小,或者维持期通过靶向免疫治疗清除了微量的污染细胞。 相较于“体外”净化,临床医生更注重改进诱导化疗方案,实现“体内”净化。(3)维持期:利用新型药物和治疗方法,进一步清除残留肿瘤细胞和不断复活的G0细胞。推荐的治疗方案是以GD2单抗为核心,以IL-2、GM-CSF和13-cis RA为辅助剂,进行免疫攻击和诱导分化[27]。GD2单抗主要有两种类型,3F8(鼠源)和ch14.18(人鼠嵌合体)。此外,口服二氟甲基鸟氨酸(DFMO)维持治疗可有效降低复发率,其原理可能是DFMO可以靶向肿瘤干细胞并使其沉默。由于国内尚无GD2单抗或DFMO药物,针对骨髓中微小残留病灶的肿瘤抗原受体(CAR)-T治疗可能可行。
8 展望
随着单细胞技术的突破,对NB的研究和认识将推进到“精准”阶段,有利于探索新的治疗方法。神经节细胞NB是单细胞研究不可多得的天然模型,是NB的一个病理亚型,特点是:静态上,同一标本中共存两种细胞,即原始神经母细胞(未分化)和成熟的神经节细胞(已分化);动态上,存在间质向上皮细胞转化(MET)过程,即部分原始神经母细胞分化为成熟的神经节细胞。由于以上特点,神经节细胞NB是研究肿瘤增殖分化的最佳“材料”。此外,神经节细胞NB还存在基质细胞——雪旺细胞和肿瘤浸润淋巴细胞(TIL),为探索肿瘤基质细胞的作用和免疫治疗提供了良好的材料。 (1)神经母细胞及神经节细胞:神经母细胞处于未分化的原始状态,属于恶性细胞。神经节细胞是由神经母细胞分化成熟的良性细胞。二者基因组学及转录组学的差异分析有利于在分子水平上认识分化、增殖,有利于靶向及免疫治疗靶点的选择。(2)许旺细胞:许旺细胞是NB的主要间质细胞,高密度的许旺细胞提示预后良好。2004年作者发表综述,详细介绍了许旺细胞发挥抗肿瘤作用的方式。对许旺细胞的研究有利于认识肿瘤基质与肿瘤细胞的起源及相互作用,最终达到改造许旺细胞以促进其发挥抗肿瘤作用的目的。(3)TIL:NB中存在TIL的病例预后良好。 它有意义的是,要分离,筛查和注入身体以进行免疫疗法,但是很难分离到足够的til,可以通过实体肿瘤组织屏障,并克服肿瘤免疫抑制的微观环境,以使其独特的分子seption section septiments suble septions suble suply septiments。来自周围血液的特征,而不是从肿瘤组织中提取它们,并扩大它们以解决数量的问题。
参考文献(略)

 微信扫一扫打赏
微信扫一扫打赏
 支付宝扫一扫打赏
支付宝扫一扫打赏


用户评论
看到这个标题真的吓了一跳,我家孩子最近查出来有这病,医生说手术风险比较大,我真是不知道怎么办了,希望文章里能有一点儿关于治疗成功的案例啊!
有10位网友表示赞同!
神经母细胞瘤这种病虽然听起来很可怕,但其实很多时候还能被治愈的。别太担心,多咨询医生了解病情和治疗方案,保持积极的心态很重要。
有8位网友表示赞同!
孩子生病了真的是最让人痛心的事情,当年我也遇到过类似的情况。后来选择了中医调理配合手术治疗,效果还不错。 文章里有没有提到一些其他的治病方法呢?
有5位网友表示赞同!
这个标题让我很担心啊,我一直觉得这方面的医疗技术发展并不是很怎么样。希望文章能写具体一点儿,例如不同的治疗方案各自的成功率等等。
有10位网友表示赞同!
我也是过来人啊,当年孩子得神经母细胞瘤的时候好绝望。好在选择了正规医院治疗,最终治愈了!现在想想那段日子还是历历在目,真希望所有患有这类疾病的孩子都能迎来美好的未来!
有7位网友表示赞同!
作为家长,我们一定要注意孩子的身体健康。一旦发现异常情况,要及时到医院就诊。不要盲目相信偏方,跟着医生的嘱咐治疗才是最重要的。
有10位网友表示赞同!
文中提到的"神经细胞母瘤"跟"神经母细胞瘤"是不是同一种疾病?我对这个病了解不多,还是想详细地了解一下区别和治疗方案呢!
有20位网友表示赞同!
我的朋友的孩子最近也查出这个病来,他们现在非常焦虑。我打算分享这篇文章给他,希望能帮到他。
有6位网友表示赞同!
希望这篇文章能给出一些明确的治疗方法,以及不同年龄段孩子的治疗建议。 这些都是很多家长的担忧和困惑!
有14位网友表示赞同!
看了标题心里就乱糟糟的, 希望文章能给我们带来一些正面的消息,不要再让我们陷入绝望中去了!
有7位网友表示赞同!
小时候我曾经患过这种病,幸亏及时发现并接受治疗,现在已经完全康复了。 希望更多的孩子也能像我一样战胜疾病,健康成长。
有5位网友表示赞同!
神经母细胞瘤的发病率越来越高,这个标题提醒着我们应该加强对孩子身体健康的关注和教育!
有12位网友表示赞同!
关于儿童神经母细胞瘤的治疗方案,我还需要多做一些了解,例如手术、药物治疗以及康复训练等等,希望文章能够详细介绍一下。
有7位网友表示赞同!
作为医生,我看到这类病患时都会尽力为患者和家人提供最好的支持和建议。 我希望这篇文章能够帮助更多人了解更多关于儿童神经母细胞瘤的知识!
有10位网友表示赞同!
这个标题让我感到既害怕又好奇,想了解一下这种癌症的症状、治疗方法以及预测等等!
有7位网友表示赞同!
希望这篇文章能提供一些具体的诊断和治疗方法,以及一些预防措施,可以帮助我们更好地守护孩子的健康!
有11位网友表示赞同!
我身边也有朋友的孩子得了这个病,他们家一直在焦虑和担忧中度过。 希望能看到文章里关于鼓励与支持的分享,给这些家庭带来力量!
有14位网友表示赞同!